In vitro 神経細胞モデルは、神経細胞の機能や複雑なヒトの神経システム障害の研究に大変有用です。アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症 (ALS) などの神経疾患は、健常者の神経に進行性の変性をもたらします。また、自閉症、ダウン症候群、統合失調症などの神経発達障害は、脳の発達や機能に大きな影響を及ぼします。これらの神経疾患の研究においては、神経回路網とその経時的変化の検証が必須です。
Maestro Pro、Edge マイクロエレクトロードアレイ (MEA) システムは、神経疾患の研究に大変有用です。MEAプレート上に埋め込まれた複数の平面微小電極にて神経細胞の電気的な活動を検出します。ラベルフリーの測定は、長期間に渡る神経活動の経時的変化の検証に最適です。また、マルチウェルフォーマットのプレートで、1度の培養・試験で異なるモデルの比較も容易です。
変異が神経機能に及ぼす影響の探索
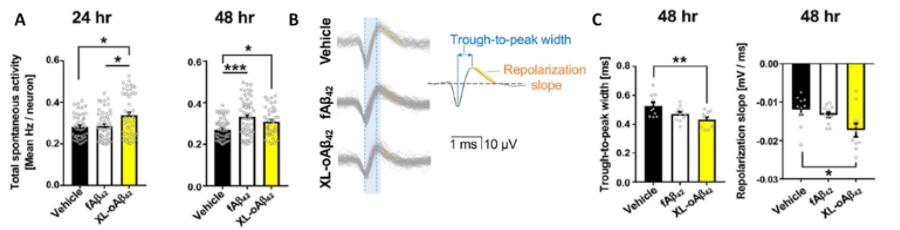
慢性的な神経炎症は、ミクログリアのアミロイドβ (Aβ) を除去する機能を低下させ、アルツハイマー病における認知機能低下の原因となります。本研究では、 Aβ42 オリゴマーが神経細胞に与える影響を調べ、末梢免疫細胞がシナプスを損傷から守ることができるかを探索しました。Maestro MEAデータにより、わずか24時間後にAβ42オリゴマーがシナプス統合性を低下させ、電気的活動を改変させることが示されました。また、活性化された骨由来マクロファージと共培養することで、シナプスが維持されることも示されました。 [Li et al. 2020.]
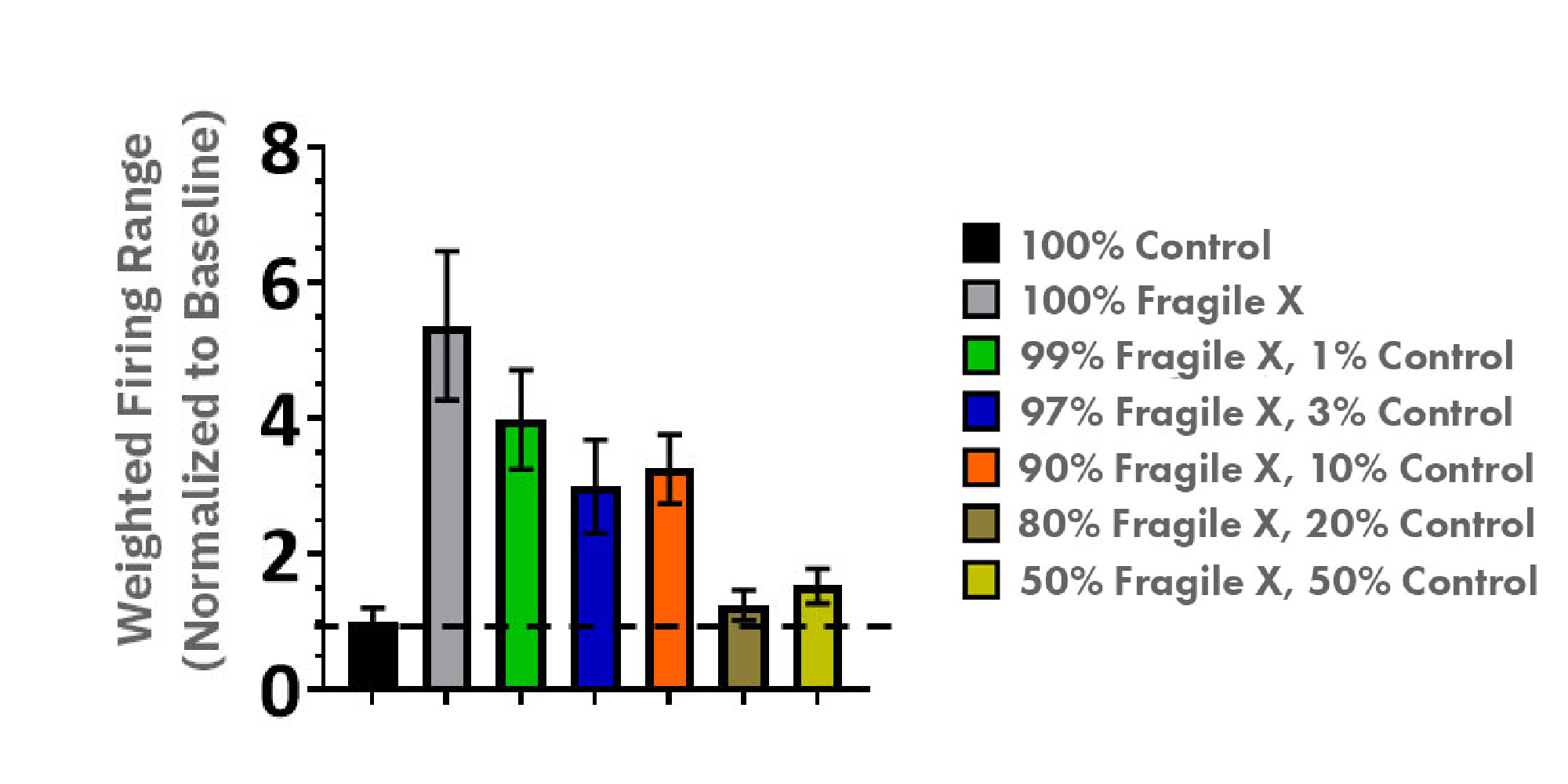
iPSC由来脆弱X症候群モデルにおいて、FMR1とFMRPの発現が、アイソジェニックコントロールと比較して、顕著に減少していることが特徴づけられました。それに対応したネットワーク電気生理学の表現型では、培養21日以降で、興奮性(加重平均された発火頻度)の増加が得られました。 脆弱Xモデル神経細胞と健常者モデル神経細胞 (Control) を異なる比率で共培養した結果、疾患モデル神経細胞の活動を、コントロールレベルまで回復させるのに必要とされる健常者モデル神経細胞比率は、わずか20%であることが明らかになりました。[Liu et al.]
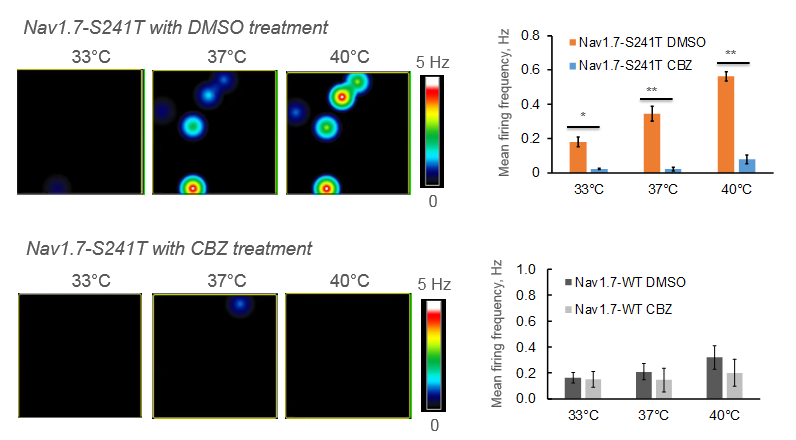
肢端紅痛症は、主に手足に現れる慢性疼痛症候群で、温度上昇に対する強い痛み反応で知られています。本研究では、その原因遺伝子であるNav1.7-S241変異を発現させたDRG 神経細胞をMEAプレート上に培養し、電気的な活動を測定しました。カルバマゼピン (CBZ) の投与により、温度上昇による発火頻度の上昇が抑制されました。また、同変異を持つ2人の患者にカルバマゼピンを投与したところ、プラセボと比較して痛みの持続時間が減少しました。 [Mis et al. 2018]
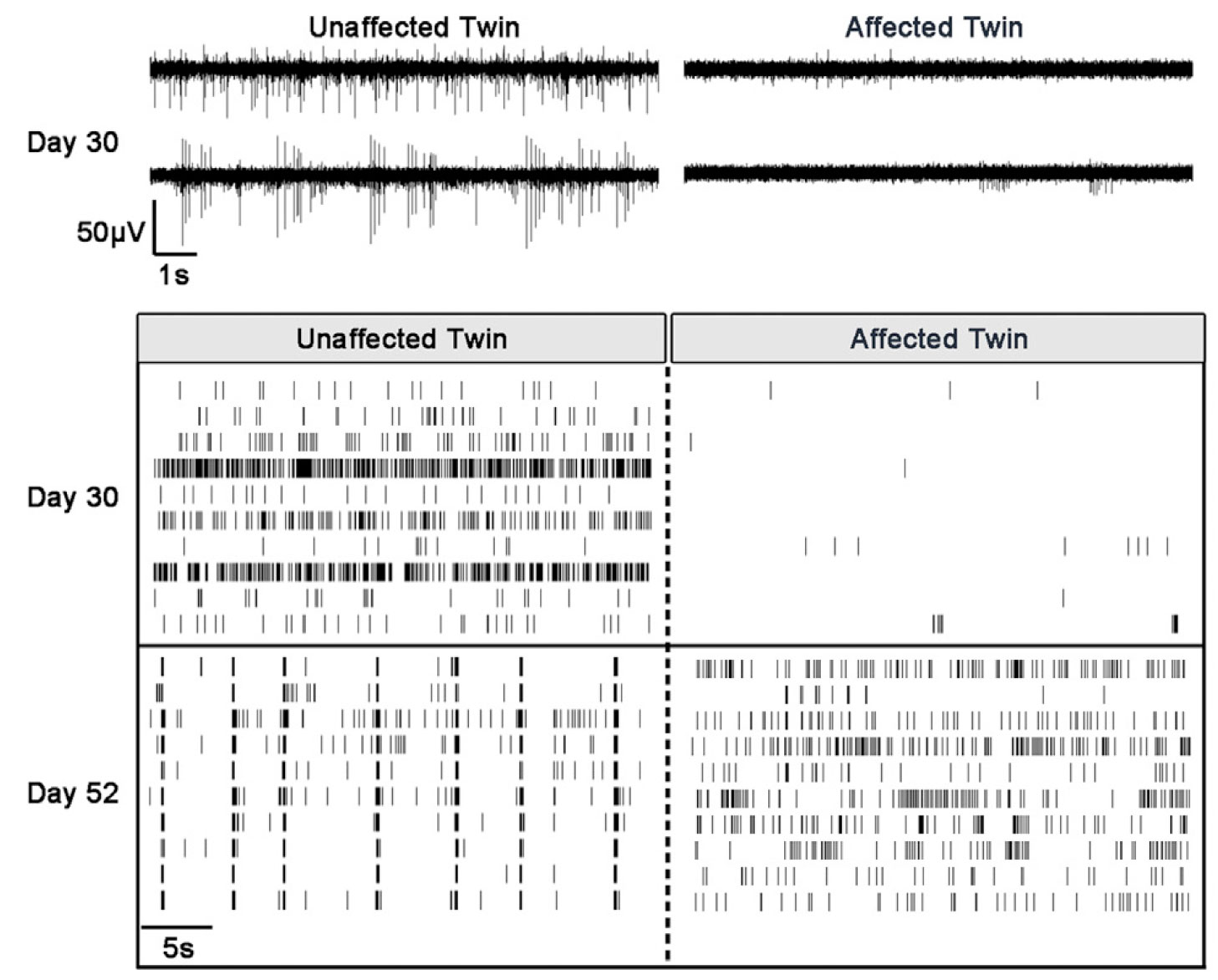
健常者とパーキンソン病患者の一覧双生児から得たiPS細胞由来神経細胞の電気的な活動をMaestro MEAにて比較しました。培養30日後、健常者の細胞からは発火が得られましたが、疾患モル細胞からの発火は微弱でした。52日後、健常者モデルでは同期的な活動が得られました。一方、疾患モデルは発火頻度は増加したものの、同期は得られませんでした。本研究では、Maestro MEAにて得られたデータが、パーキンソン病の遺伝的および非遺伝的原因への理解に貢献しています。[Woodard et al]
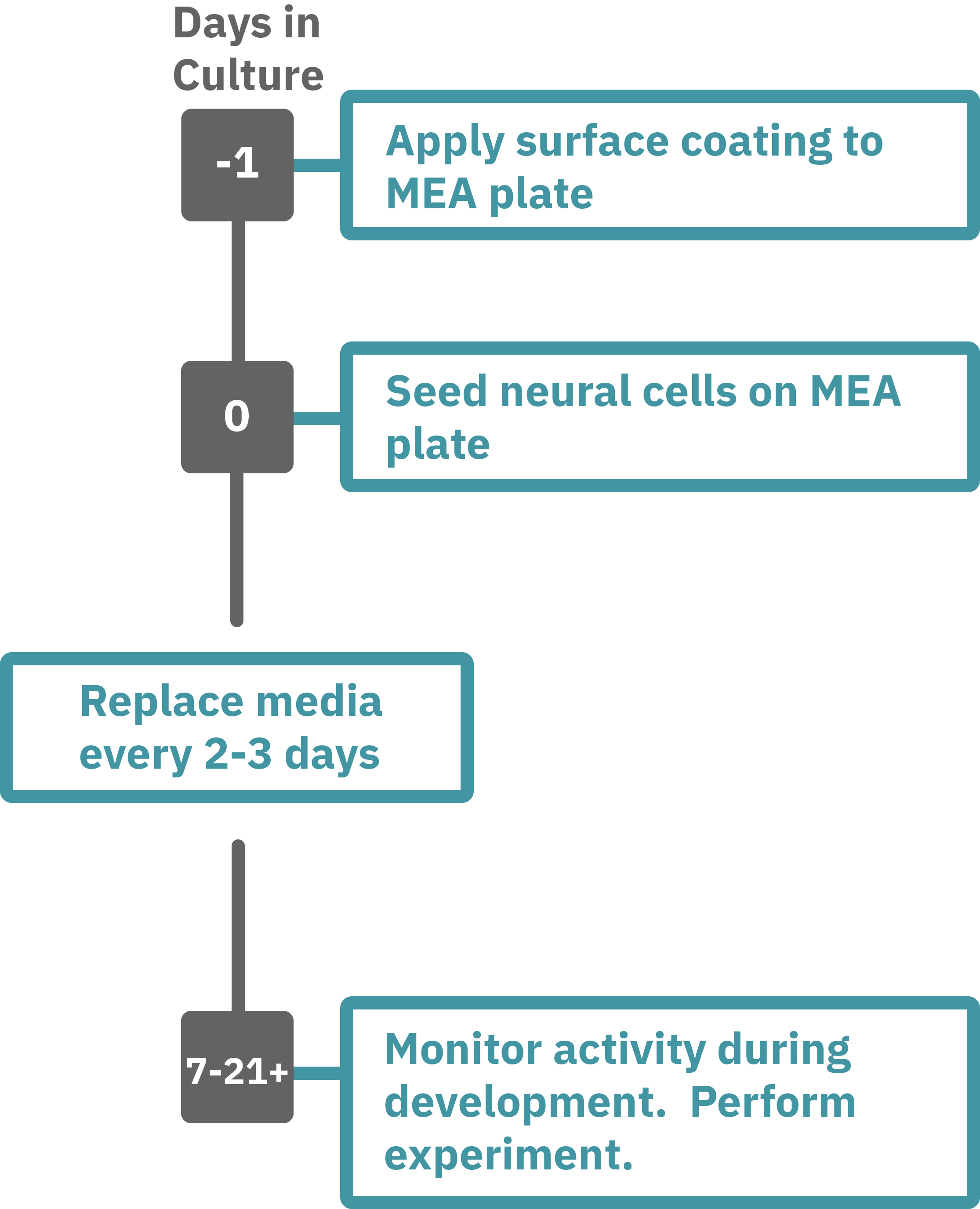
Maestro Pro、Edge によるアッセイは非常に簡単です。
コーティングされたマルチウェル MEAプレート上に神経細胞を播種し(Day 0)、2-3日毎に培地交換をしながら培養します。
7-21+日後にプレートを Maestro に搭載し測定を行います。非侵襲電極により、繰り返しの測定が可能です。データはAxIS Navigator 神経ジュールソフトウエアにてで解析可能です。





