キメラ抗原受容体(Chimeric Antigen Receptor; CAR)-T細胞治療は、遺伝子改変T細胞を患者に投与し、がん細胞を攻撃させます。CAR-T細胞療法開発の成功には、以下が必要とされます。
- >> 適切な抗原ターゲティング
>> CARの最適化
>> 予測に基づいた効力評価
>> 免疫細胞の疲弊/持続性の評価 - これらの課題に取り組み、安全で強固な免疫細胞製品を開発することは極めて重要です。当社のライブセル解析プラットフォームでは、CAR-T細胞の表現型、効力、および持続性の評価が可能です。
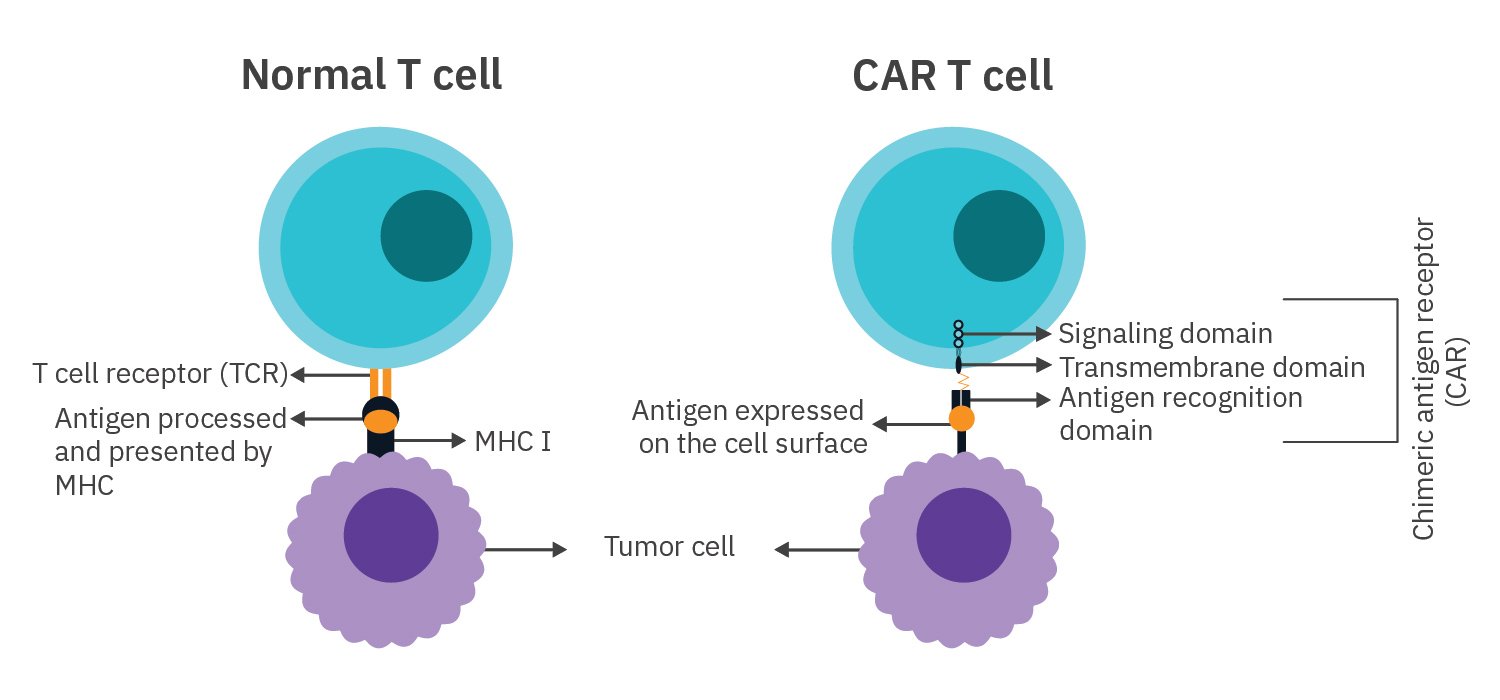
T細胞とCAR-T細胞
非修飾T細胞の受容体(TCR)は、MHCによって提示された抗原を検出します。一方、CAR-T細胞のキメラ抗原受容体(CAR)は、標的細胞に発現された抗原を認識します。
CARの構造
- シグナル伝達ドメイン - T細胞の活性化と増殖を刺激する
- 膜貫通ドメイン - CARを膜に固定する
- 抗原認識ドメイン - 標的細胞の抗原を認識し結合する
CAR-T細胞療法アッセイ
-
イメージングシステムを用いた CAR の最適化>
-
CAR-T細胞による特異的キリングの評価>
-
固形がんスフェロイドに対するCAR-T細胞有効性の検証>
-
CAR-T細胞疲弊 (exhaustion) の評価>
-
CAR-T細胞による細胞傷害の測定>
-
アプリケーションノート : 細胞治療における安全性評価のための、機能的心毒性アッセイの開発>
CARの最適化は、効果的な in vitro 腫瘍免疫アッセイ の開発にとって極めて重要です。 Omni ライブセルイメージングシステム を用いて、異なるCARコンストラクトによるキリングを比較しました。容量依存的な細胞死が観察されました。
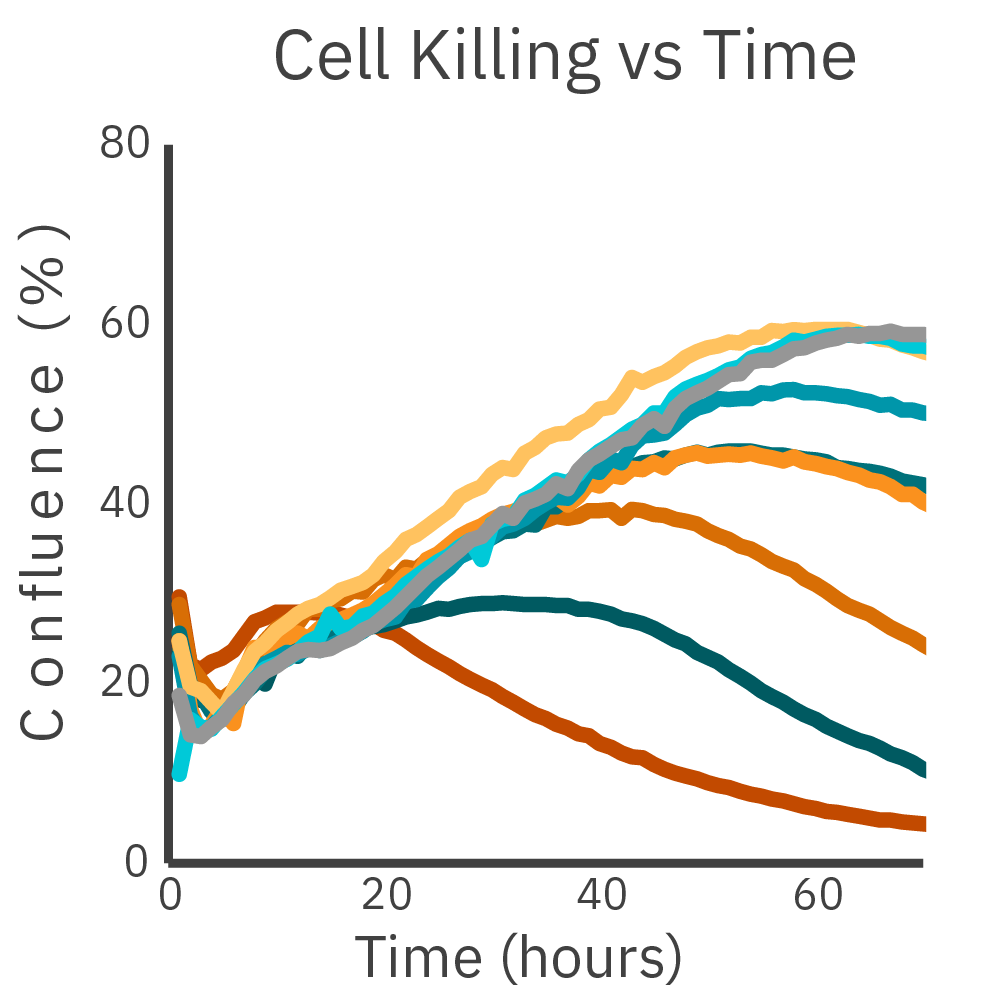
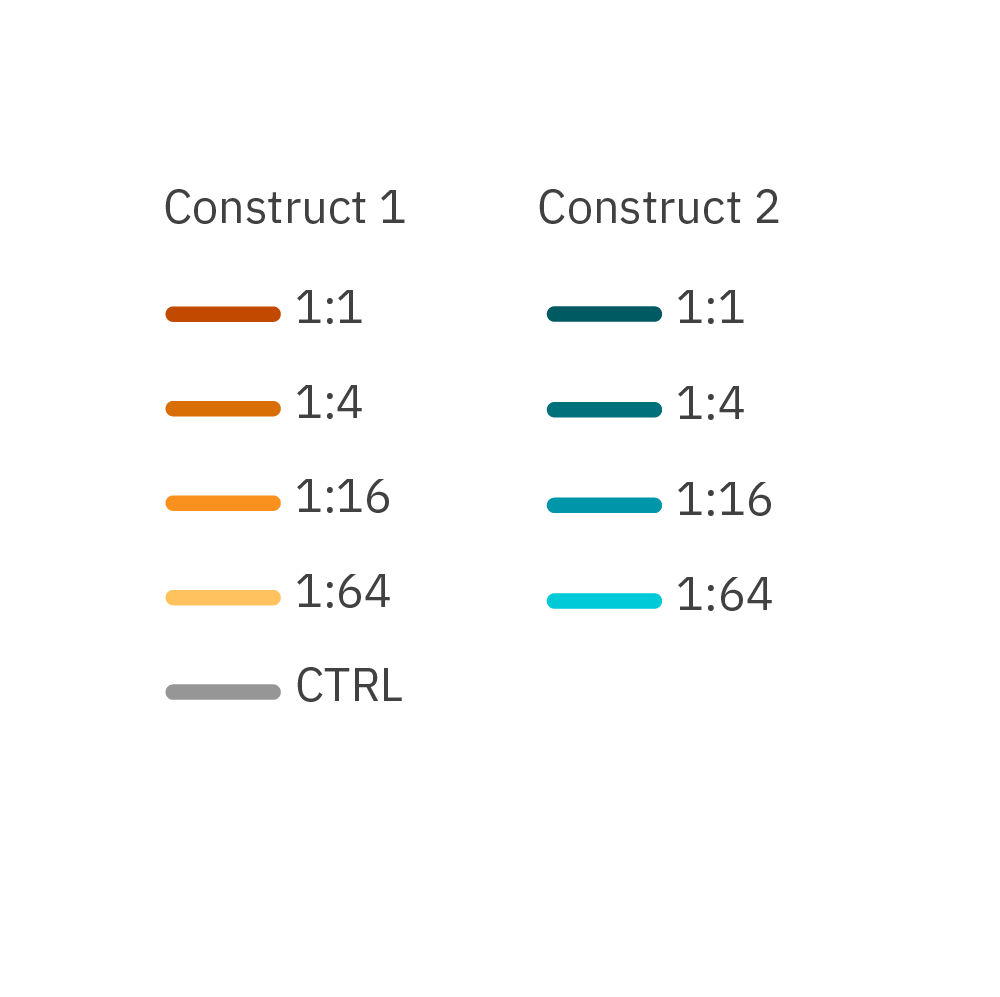
CAR-T細胞を添加し、 Omni プラットフォームを用いて、RFPでラベリングしたがん細胞のコンフルエンシーを測定しました。異なるE:T比で 2種類のCARコンストラクトを比較したところ、全てのE:T比において、コンストラクト1がより高い効力を示しました。
目的: CAR-T細胞による、特異的キリングと非特異的キリングを識別しました。高い特異的キリングは、CAR-T細胞療法の安全性と有効性につながります。
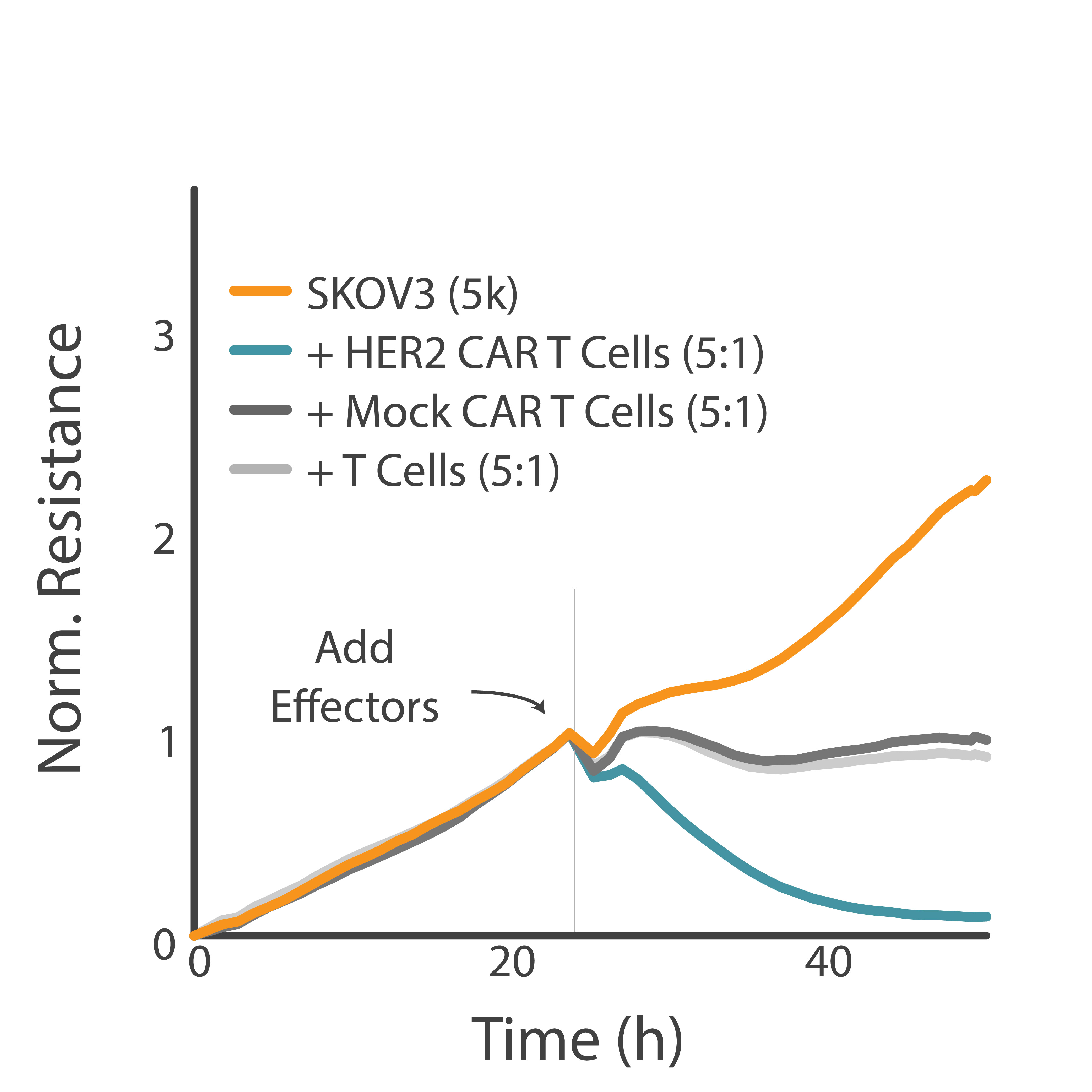
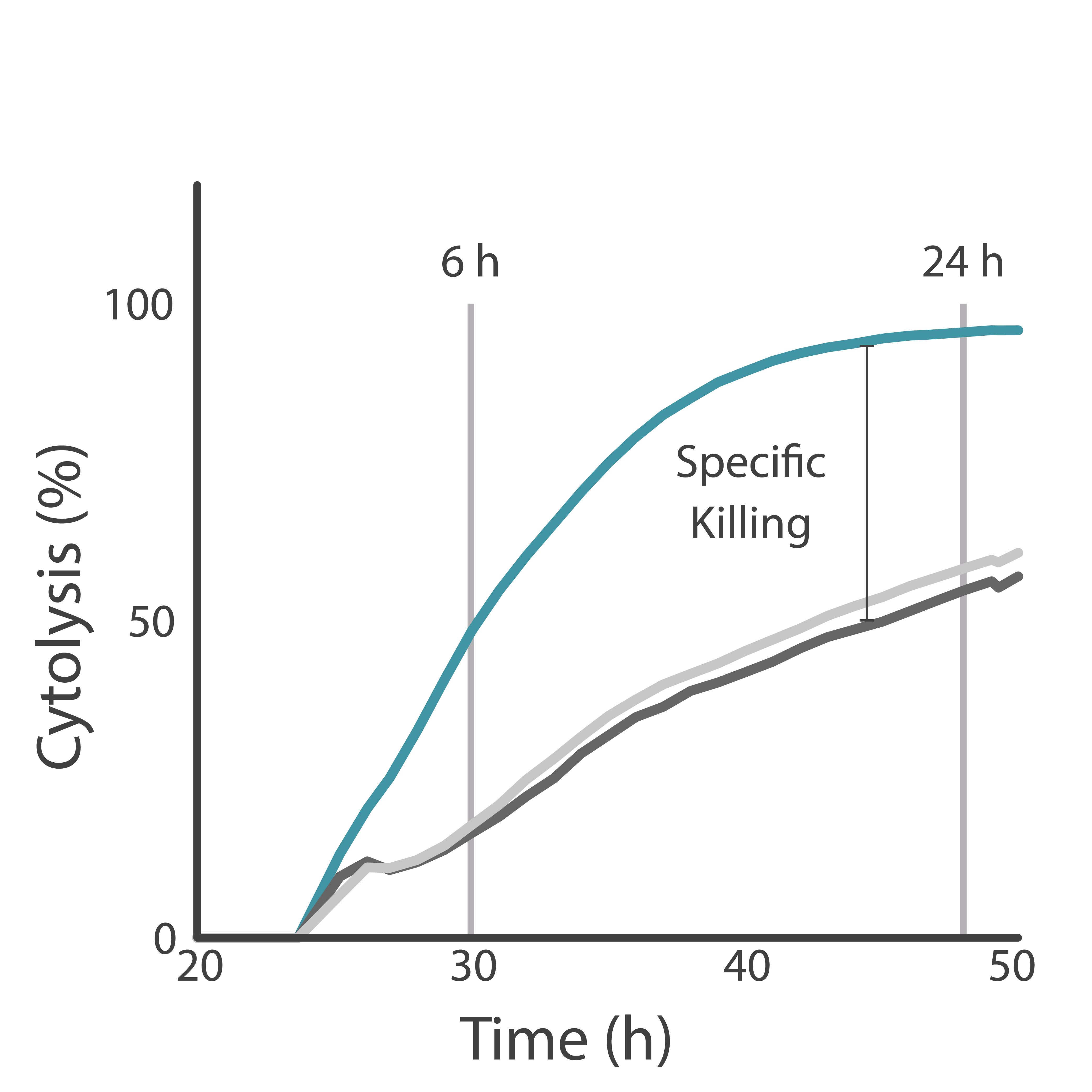
HER2を過剰発現させたがん細胞を、腫瘍抗原認識ドメインを持つCAR-T細胞と持たないCAR-T細胞でそれぞれ処理しました。 Maestro Z プラットフォームを用いて、両 CAR-T細胞によるがん細胞キリングを測定しました。
結果: 抗原認識ドメインを有するCAR-T細胞による、HER2標的キリングが示されました。
目的: 固形がんは、液性腫瘍や2次元単層培養と比較して、免疫療法にさらなる困難をもたらす可能性があります。3Dスフェロイドに対する、CAR-T細胞のキリングを追跡しました。
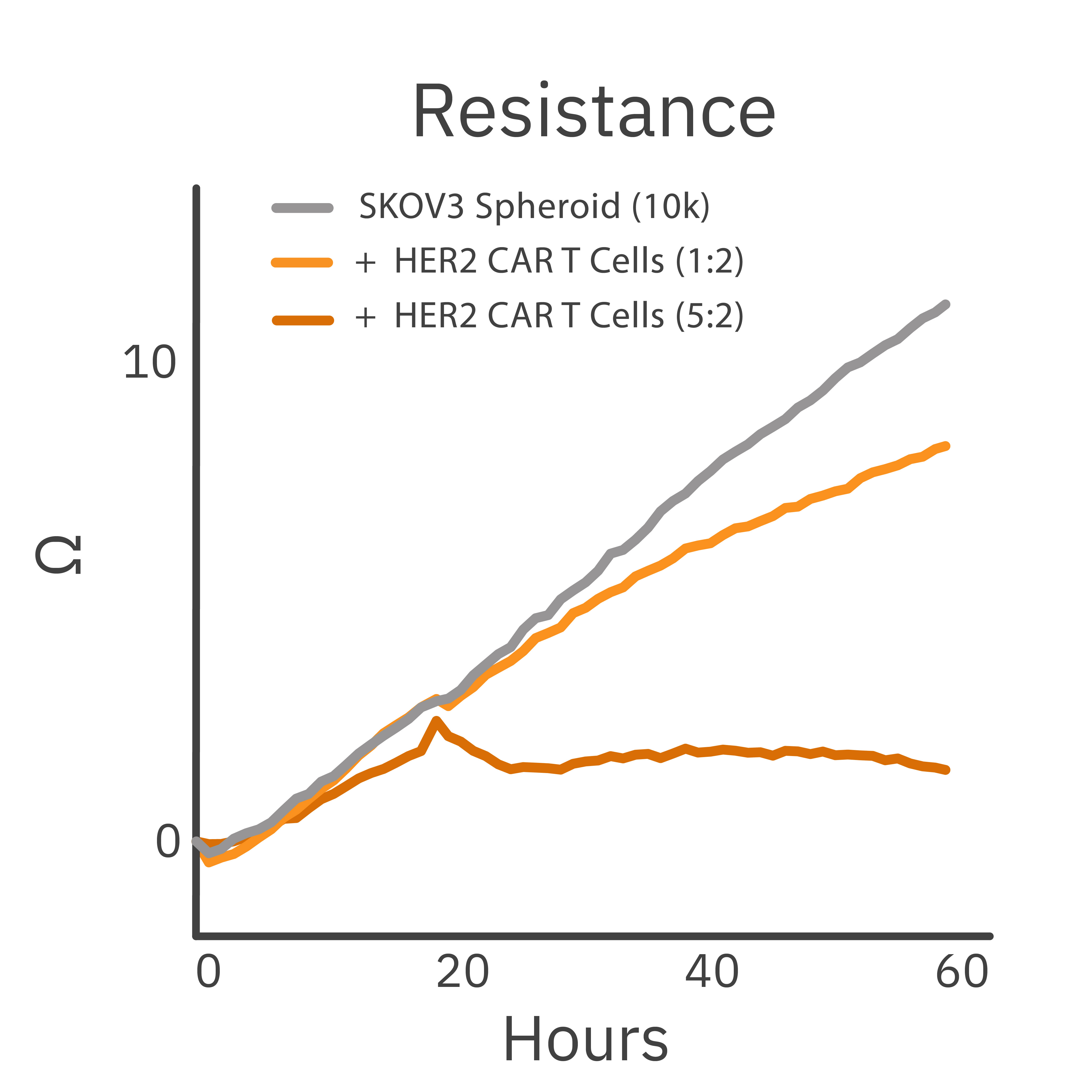
がん細胞スフェロイドをCAR-T細胞で処理し、 Maestro Z プラットフォームにて傷害を測定しました。
結果: CAR-T細胞処理により、がん細胞スフェロイドのサイズが、濃度依存的に減少しました。
目的: CAR-T細胞による殺傷の持続性を評価しました。T細胞疲弊 (exhaustion) は、患者の腫瘍根絶を妨げるハードルとなります。
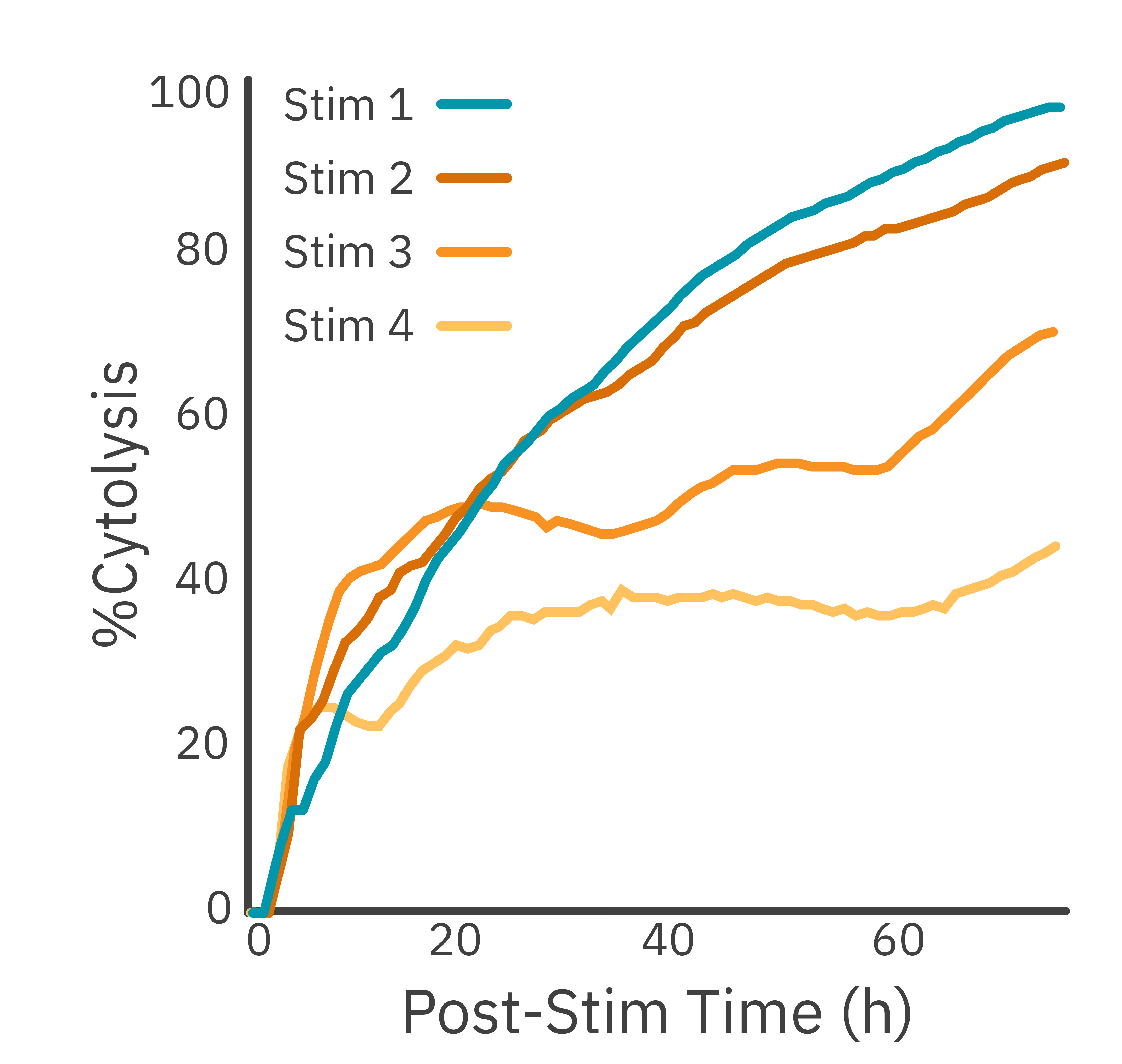
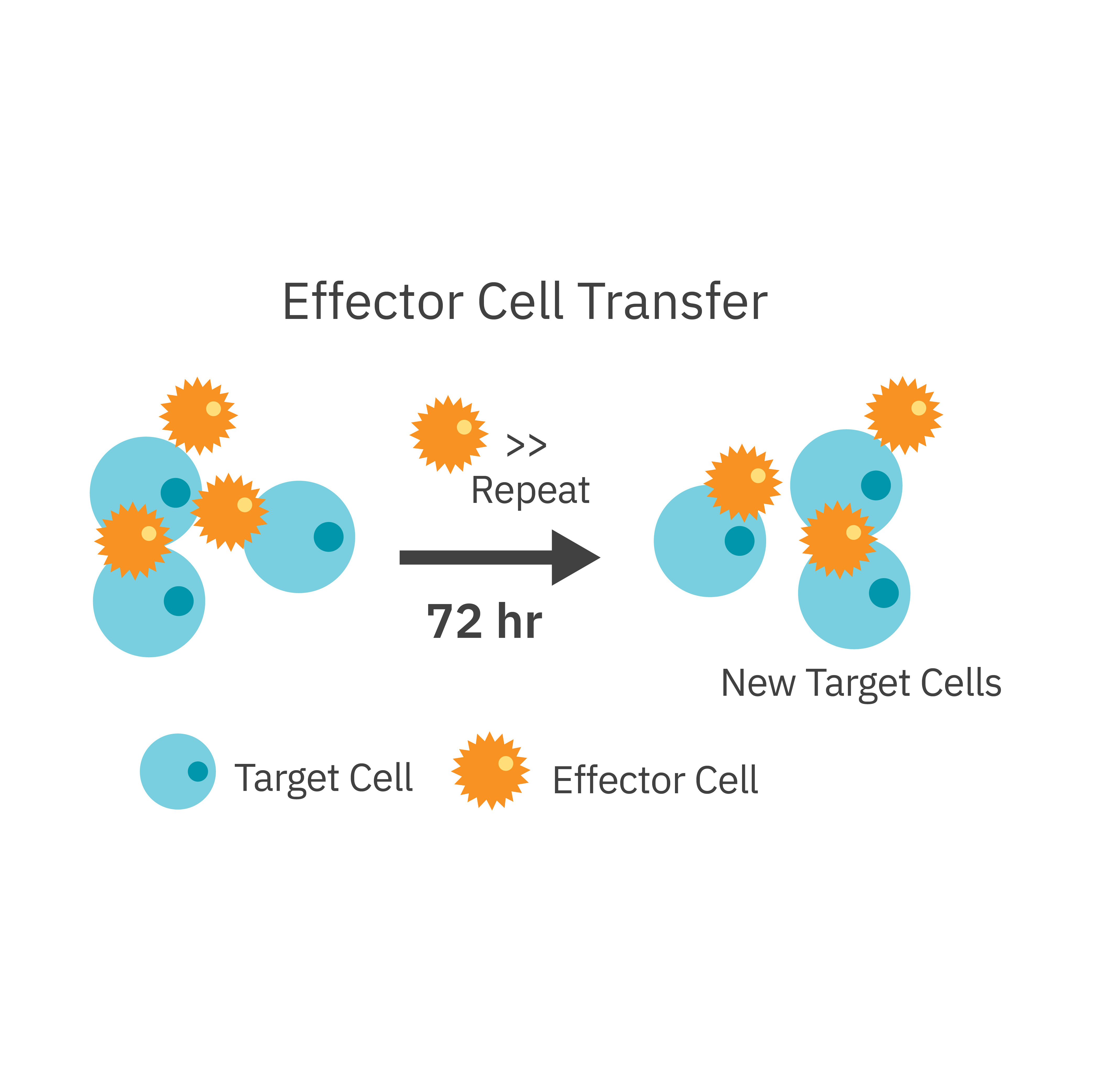
ターゲットがん細胞に、エフェクター CAR-T細胞を添加しました。72時間ごとに、エフェクター細胞を回収し、同じ比率で新しいターゲット細胞に移植しました。 Maestro Z プラットフォームを用いて、ターゲット細胞キリングを評価しました。
結果: CAR-T細胞が順次移植されるたびに細胞傷害は減少し、その効力が弱まることが示されました。
目的: がん細胞にHER2抗原を異なるレベルで発現させ、CAR-T細胞による殺傷効力を測定しました。抗原受容体のレベルは、CAR-T細胞による傷害に影響を与えることが示されています。
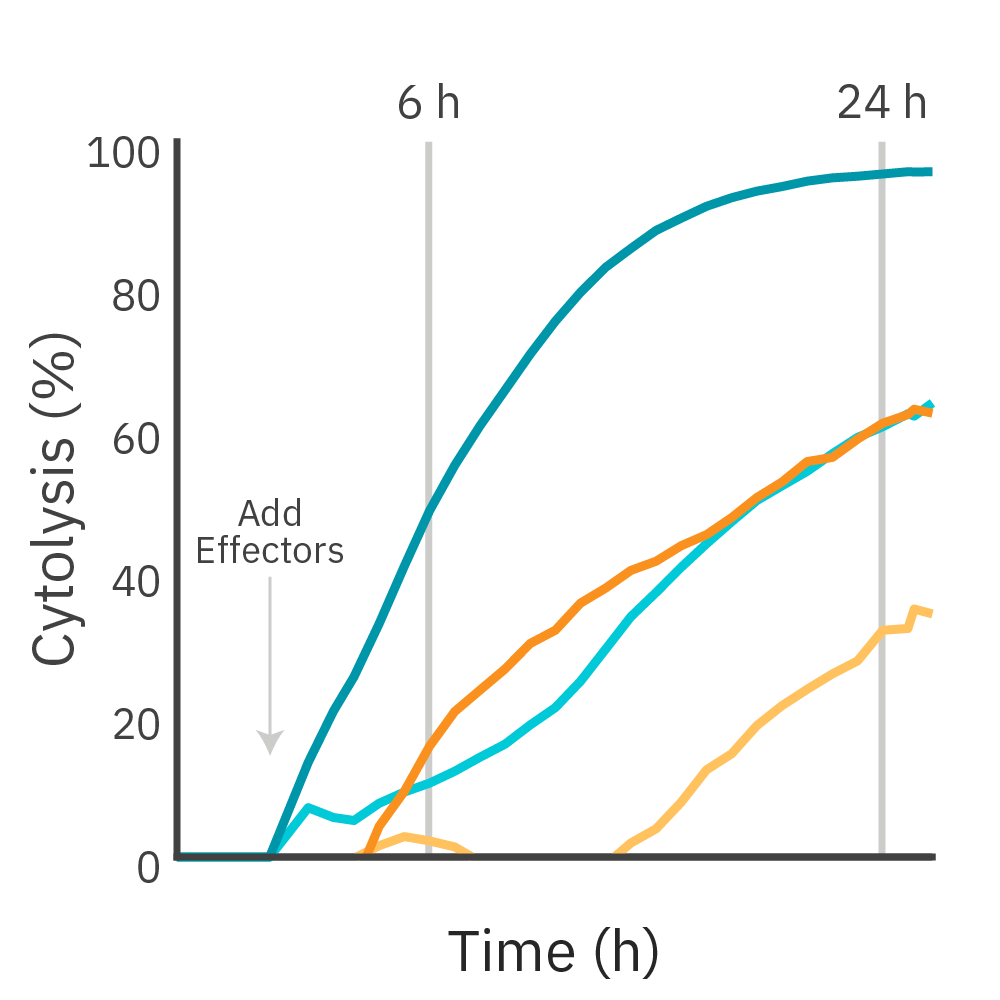
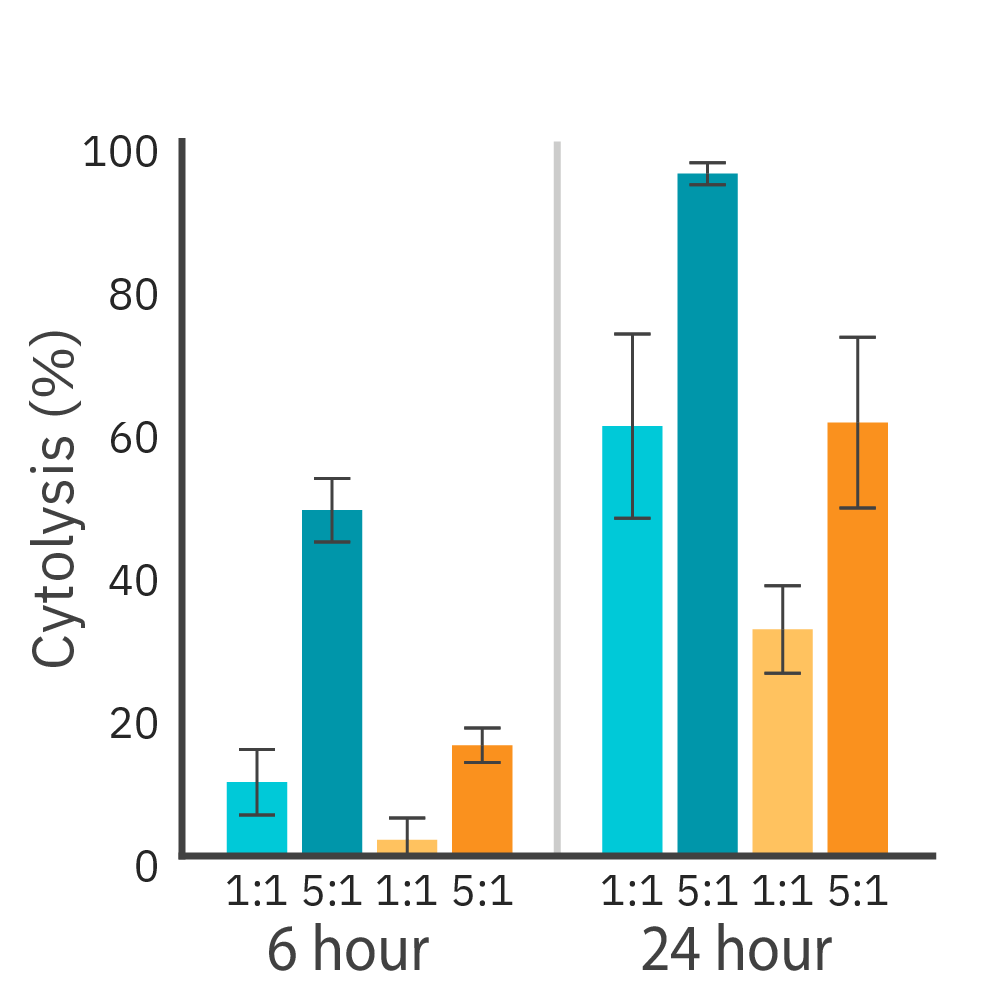

HER2抗原を標的とするCAR-T細胞を、2種類のがん細胞株に添加し、 Maestro Z プラットフォームを用いて傷害の強さを比較しました。
結果: いずれの標的細胞株、エフェクター:ターゲット比率に対して、CAR-T細胞によるキリングが観察されました。また、傷害の速度は、標的抗原の発現レベルに比例しました。

本アプリケーションノートの概要:
>> HER2標的 CAR-T細胞による、 in vitro iPSC-心筋細胞殺傷が示された。
>> 一方で、非修飾T細胞はiPSC-CMに対して毒性を示さなかった。また、HER2標的CAR-T細胞はiPSC由来ニューロンを殺傷しなかった。
>> HER2標的CAR-T細胞はiPSC-心筋細胞の電気生理学的変化を誘導したが、その多くは生存率の変化が観察される前であった。


