細胞シグナル伝達経路は、細胞の外から来たメッセージを伝達します。細胞外の分子が細胞表面の受容体に結合すると、細胞内のシグナリングが始り、細胞が反応します。これらの微細な変化は急激に起こることが多い一方で、数分から数時間にかけて持続し、身体に重大な影響を及ぼすこともあります。
Axion BioSystems の Maestro では、インピーダンス変化の検出により、細胞の変化をラベルフリーで連続して、測定・解析することが可能です。数日間に渡る連続したデータ測定は、受容体媒介シグナリングなどのカイネティクスに関するより多くの理解が得られます。
受容体介在シグナリングの検証
Gタンパク質共益受容体 (G protein-coupled receptor、GPCRs) は、最大の貫通型受容体の1つです。GPCRの結合は構造変化と下流の応答として現れますが、これらの変化をMaestro のインピーダンス測定で検出することが可能です。本事例では、Maestro Zを用いて、Calu-3細胞株の、イソプレテレノール、ヒスタミン、サイトカラシンDへの応答を、数日間に渡り連続して測定しました。各化合物に対する細胞の応答のカイネティクスの差異が顕著に示されました。
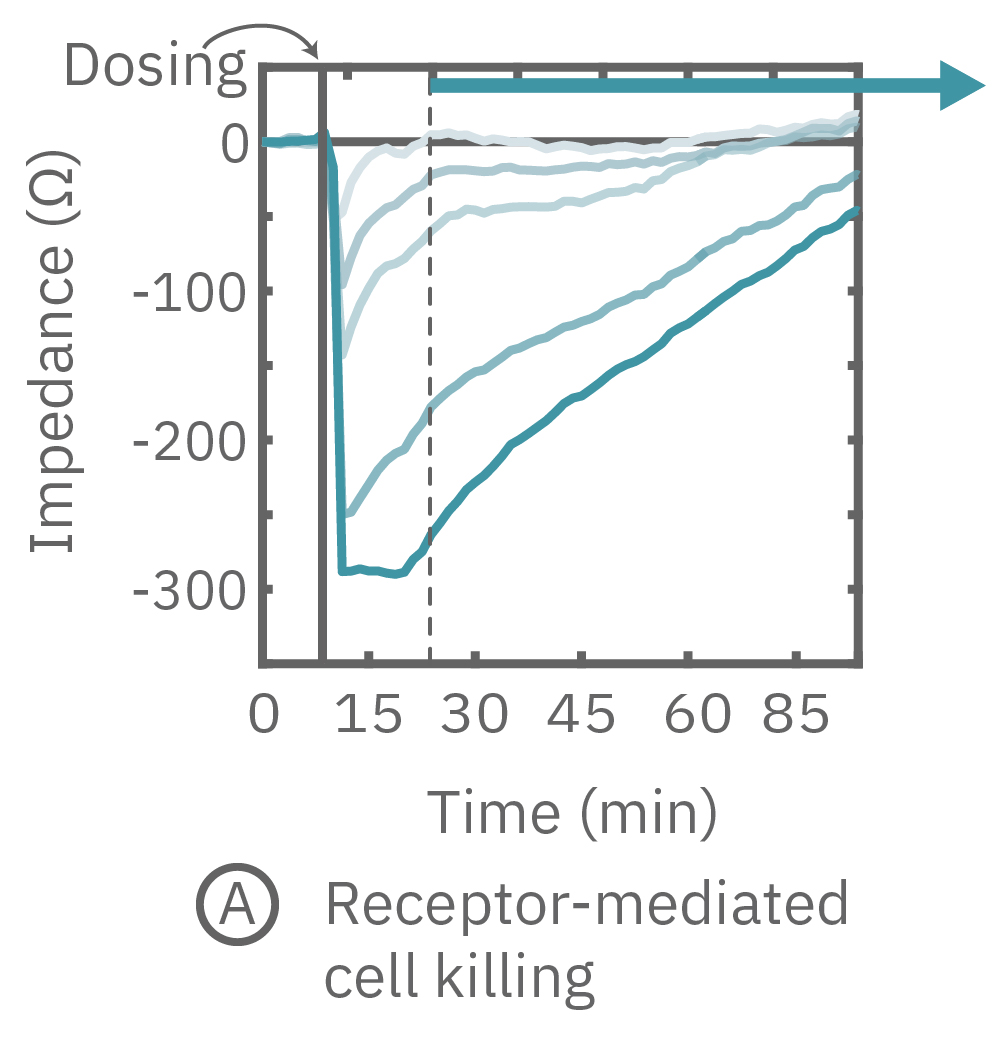
(A) CytoView-Z プレート上にCalu-3細胞を播種し、Maestro Zにてインピーダンスを測定した。βアドレナリン受容体作動薬であるイソプロテレノールを投与したところ、急激なインピーダンスの減少が得られた。
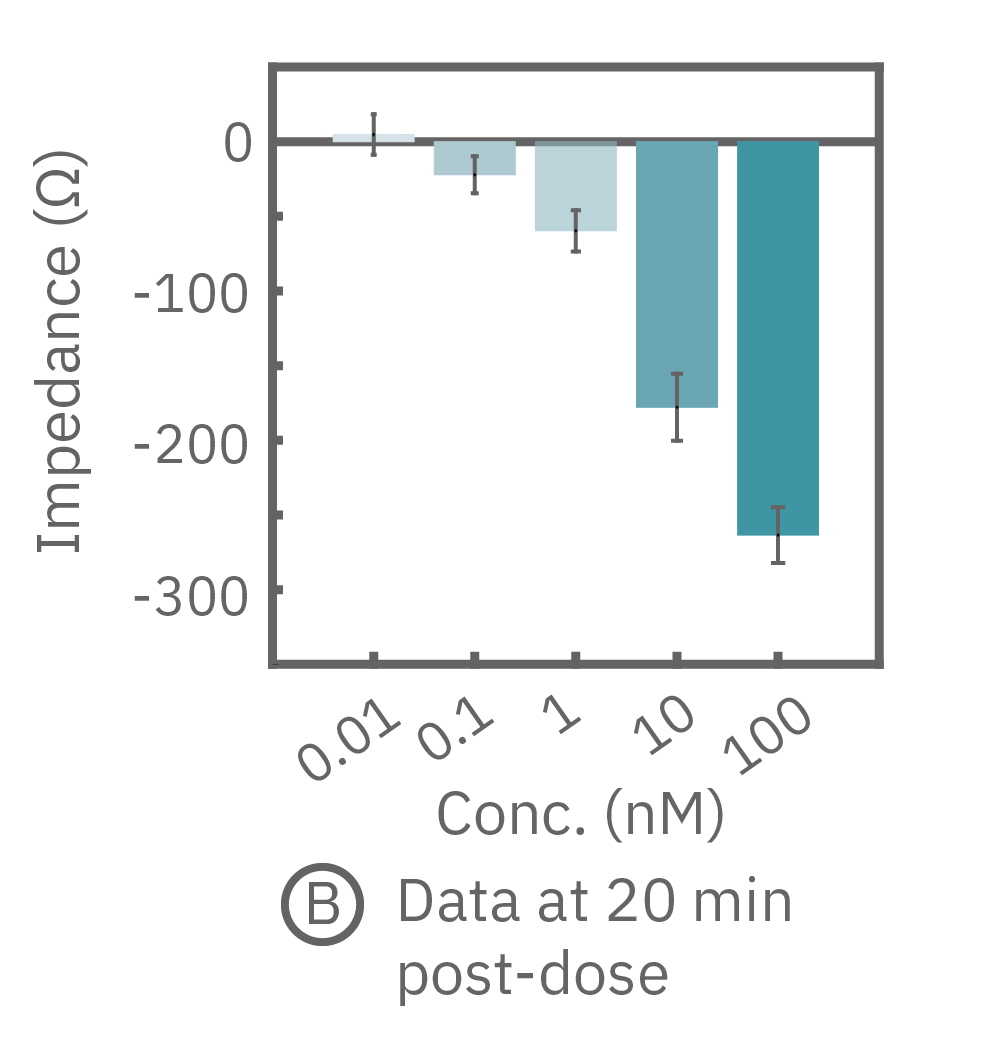
(B) イソプレテレノール投与から20分後(A図点線箇所)のインピーダンス値を示す。高濃度投与においてインピーダンス値が最も低く、また最低濃度投与のインピーダンスは投与前の状態に回復した。
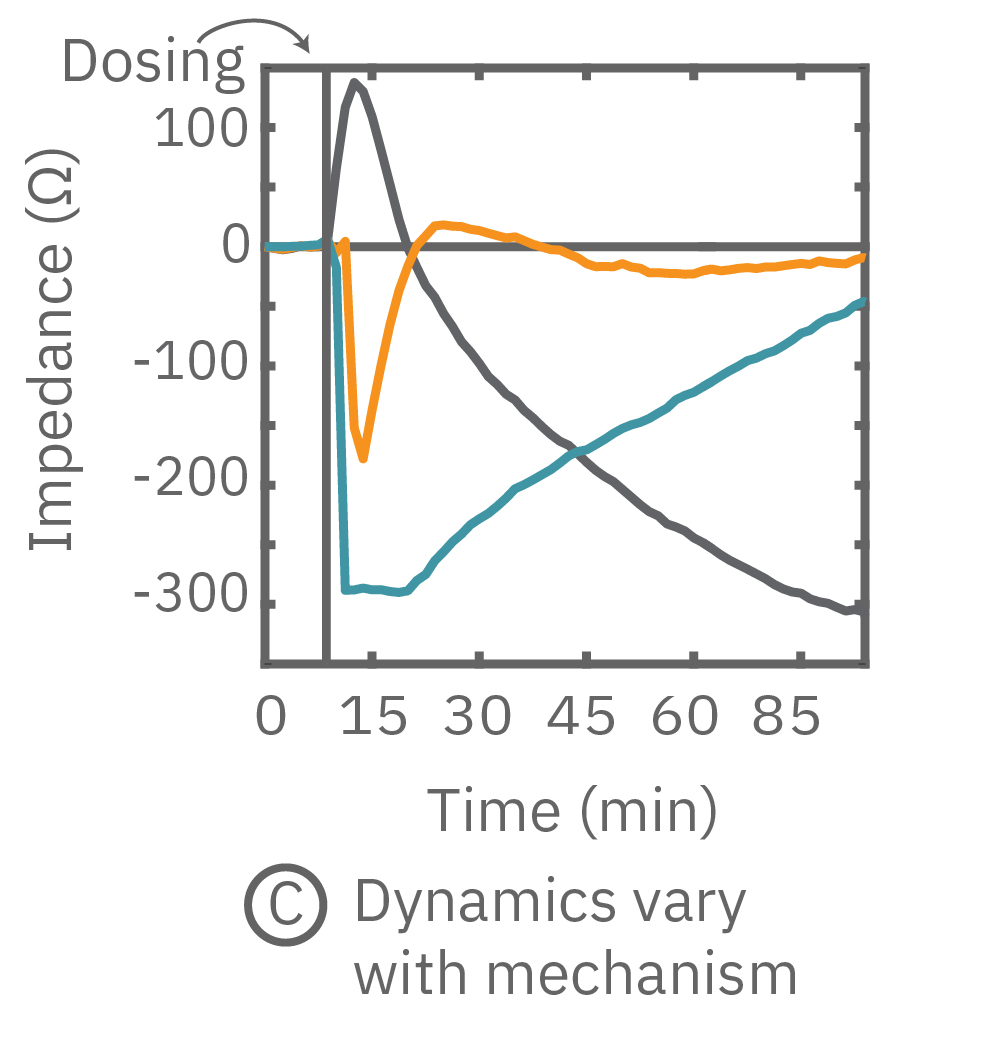
(C) 3種の化合物投与によるインピーダンスの変化を示す。ヒスタミン(オレンジ色、100 μM) 投与においては、インピーダンスが急激に減少した。また、サイトカラシンD(グレー色)投与においては、投与直後に急激に増加した後、緩やかに減少し、アクチン重合阻害と細胞周期停止が示唆された。
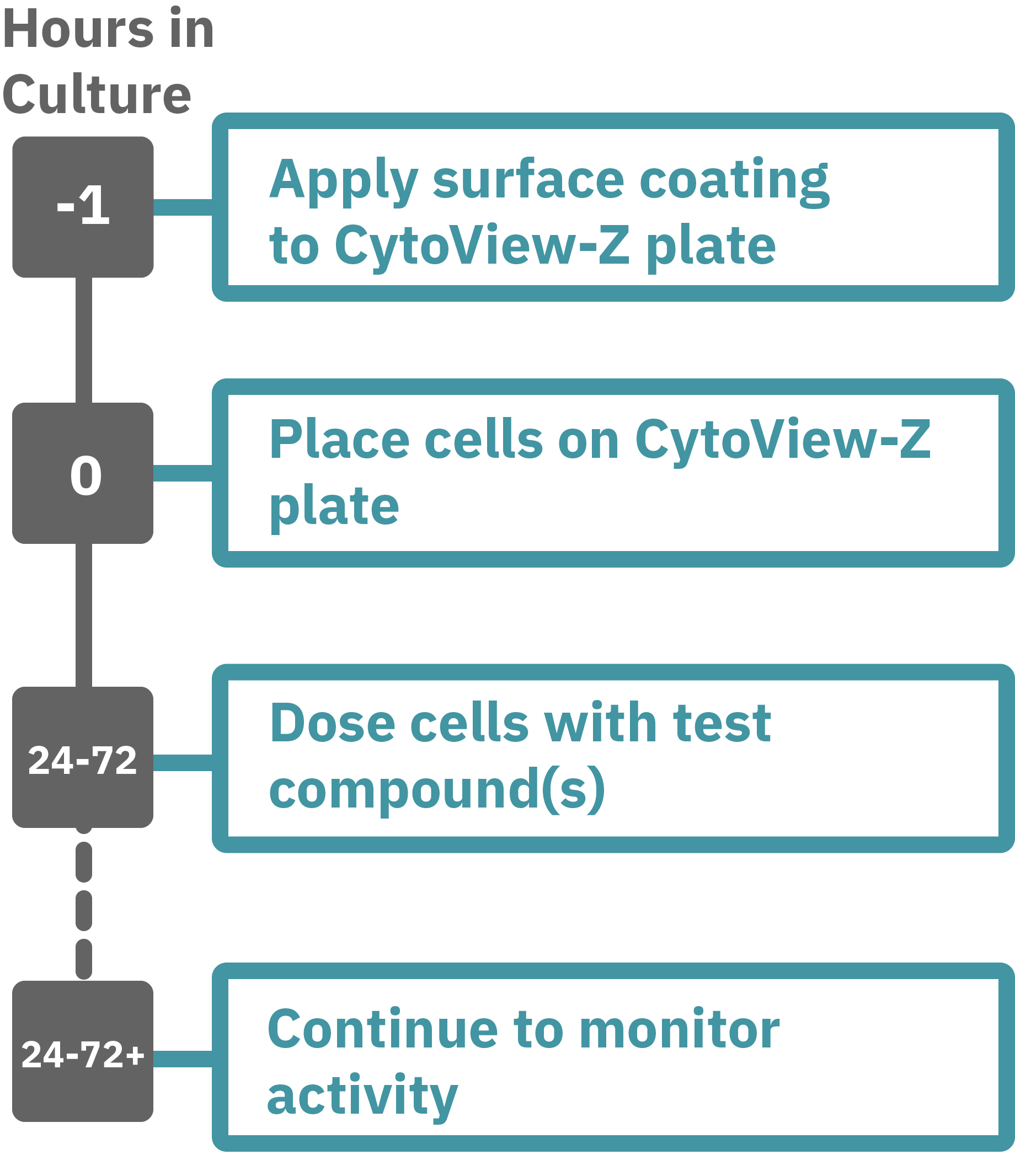
Maestroによるインピーダンスアッセイはとても簡単です。事前コーティングされた CytoView-Zプレート上に細胞を播種します (Hour 0)。Maestroシステムにプレートを搭載すると同時に、温度・CO₂ 濃度制御とインピーダンス測定が開始されます。細胞の増殖・電極への接着に伴いインピーダンスが上昇します (Hour 0 ~ 24-72)。
細胞がプレート上でコンフル状態なった後、化合物などを投与し、以降数日間に渡って細胞シグナル伝達をラベルフリーで測定します。

Maestro Z/ ZHT, Pro/EdgeによるGPCR細胞シグナル伝達アッセイ : 特徴
-
経時的観察 - 96或いは384 well 同時に測定します。GPCRなど細胞シグナル伝達を連続して測定し、専用アプリで、実験室の外からでもライブデータの確認が可能です。
-
ラベルフリー - 平面電極によるインピーダンス測定は、染色・試薬などを必要としません。ラベルフリー測定で数日間に渡る測定・観察が可能です。
-
インキュベータ不要 - Maestroには温度・CO2濃度コントローラが内蔵されています。インキュベータ等の周辺装置は不要。安定した環境下で数日間に渡る連続測定が可能です。
-
細胞可視 - CytoView-Z 96 well プレート底面中央部は透明になっています。必要に応じて、細胞の観察が可能です。
-
培養から測定まで同一プレート使用 - アッセイの全行程を同一プレートで行います。他のハイスループット・プラットフォーム(例:フローサイトメータ)のような容器の入れ替えなどは不要。細胞への負担を最小限に抑えることができます。
-
スマートフォン・アプリ - 専用のスマートフォンアプリに対応しています。数日間に渡るシグナル伝達変化の様子を、実験室の外からでも、リアルタイムに観察して頂けます。
-
簡単 - セミ・オートメーションシステムです。ハードウエアの操作はボタン1つ。専用のソフトは、インピーダンスの変化をリアルタイムで表示します。解析結果のエクスポートも容易です。

Impedance
Show Full DetailsWhat is impedance-based cellular analysis?
Impedance-based cell analysis is a label-free, real-time technology that monitors live cells by measuring how electrical signals change across microelectrodes embedded in the culture surface. As cells attach, spread, and respond to treatments, the Axion BioSystems' Maestro Z impedance platform provides dynamic, continuous cellular profiles — capturing both baseline behavior and drug- or immune-driven effects.
Why does real-time, label-free monitoring matter?
Traditional assays often rely on dyes, labels, or destructive endpoint measurements, which can interrupt normal biology and miss transient responses. Impedance monitoring solves this by delivering continuous, noninvasive functional readouts — enabling researchers to observe biological change as it happens, particularly in drug discovery, toxicology, and disease modeling.